(TE) Aula 3 | Videoconferência | Tópicos Especiais | Mestrado | Ciência dos Materiais - UFMS
AULA 3 | VIDEOCONFERÊNCIA | TÓPICOS ESPECIAIS
Estudo dirigido de Tópicos Especiais: Síntese e Caracterização de Materiais
AVA [UFMS] > TÓP. ESP.: SÍNT. CARACT. MAT.
Professor Dr. Sajjad Ullah diz:
"PERGUNTAS PARA PESQUISA:
1 - Por que é mais comum uso de CO2 supercrítico do que outros gases?
2 - Por que colocamos H2O na síntese mostrado no slide 26?
3 - Por que a TiO2 (anatase) em SiO2-TiO2 tem maior estabilidade térmica que o TiO2 puro?".
"PERGUNTAS PARA PESQUISA:
1 - Por que é mais comum uso de CO2 supercrítico do que outros gases?
2 - Por que colocamos H2O na síntese mostrado no slide 26?
3 - Por que a TiO2 (anatase) em SiO2-TiO2 tem maior estabilidade térmica que o TiO2 puro?".
R E S P O S T A S A B A I X O :
1 - Por que é mais comum uso de CO2 supercrítico do que outros gases?
RESPOSTA:
A princípio, o primeiro motivo é a viabilidade financeira (custo) quando comparado a outros gases. No demais o dióxido de carbono (CO2) é o fluido mais utilizado na extração supercrítica, pois possui condições moderadas em relação a sua temperatura crítica (31,3°C) e sua pressão crítica (73,86 bar), proporcionando facilidades nas condições de operações dos equipamentos, e evita a degradação dos poros do material durante seu processo de formação.
Vale frisar que, o líquido na amostra deve ser miscível com o CO2, pois ao ser injetado no sistema e subsequentemente levado ao estado de fluido supercrítico, este proporciona a secagem do material por despressurização lenta, originando materiais altamente porosos e de baixa densidade. (PAIVA FERREIRA NETO, 2018).
Outro fato importante, é demonstrado pela tabela abaixo que contém valores de temperatura crítica e pressão crítica para alguns solventes empregados na síntese do gel:
Vale frisar que, o líquido na amostra deve ser miscível com o CO2, pois ao ser injetado no sistema e subsequentemente levado ao estado de fluido supercrítico, este proporciona a secagem do material por despressurização lenta, originando materiais altamente porosos e de baixa densidade. (PAIVA FERREIRA NETO, 2018).
Outro fato importante, é demonstrado pela tabela abaixo que contém valores de temperatura crítica e pressão crítica para alguns solventes empregados na síntese do gel:
 |
Fonte:
|
Estes pontos críticos devem ser ultrapassados no processo de secagem. Logo, pode-se notar que a maior viabilidade está na utilização do CO2 como gás extrator. Vale ressaltar que, a principal vantagem de se trabalhar com o CO2 está no fato de se poder operar em condições menos drásticas de temperatura e pressão crítica. (BARBIERI RODELLA, 1997).
2 - Por que colocamos H2O na síntese mostrado no slide 26?
RESPOSTA:
Em análise ao slide 26, o qual segue representado pela figura abaixo, foi elaborado uma justificativa para este problema.
Portanto, pode-se justificar que, a adição de água (H2O) pode servir para produzir um aumento na porosidade do híbrido. No entanto, vale frisar que, os materiais híbridos a base de sílica apresenta apreciável solubilidade em solventes com elevada constante dielétrica, como água e etanol e, consequentemente, podem ser facilmente depositados sobre outras matrizes inorgânicas, ou mesmo utilizados como precursores moleculares para síntese de híbridos contendo teor inorgânico mais elevado. (BENVENUTTII, C. MORO, et al., 2009).
Fonte aqui!
3 - Por que a TiO2 (anatase) em SiO2-TiO2 tem maior estabilidade térmica que o TiO2 puro?
RESPOSTA:
É devido a estabilidade de fases entre os polimorfos de TiO2 ser majoritariamente influenciada pelos fatores entálpicos. Assim, a maior estabilidade termodinâmica da fase anatase para TiO2 nanocristalino é justificada qualitativamente pelos valores significativamente distintos de entalpia de superfície das 3 fases, conforme são representadas abaixo:
Figura 1 - Propriedades termodinâmicas de diferentes fases do TiO2:
 |
Fonte:
|
Conforme demonstrado pela figura 1 (acima), os valores de entalpia de superfície seguem a ordem crescente, anatase < brookita < rutilo.
Fonte aqui!
Parte 1:
RESUMO DA VIDEOCONFERÊNCIA (PARTE 1)
(1º SLIDE)
O PROCESSO SOL-GEL PARA PREPARAÇÃO DOS MATERIAIS HÍBRIDOS E COMPÓSITOS (SÍNTESES E APLICAÇÕES).
ESTE PROCESSO ABORDA UM MÉTODO BASTANTE VERSÁTIL QUE SE PODE UTILIZAR PARA FORMAR FILMES HÍBRIDOS, MATERIAIS EM PÓ (MATERIAIS NANO EM PÓ), MANTAS (TAMBÉM CHAMADO DE MONOLITOS DOS MATERIAIS) E TAMBÉM OS GÉIS (MATERIAL MAIS LEVE).
NESTA VIDEOCONFERÊNCIA O MÉTODO DE SOL-GEL PARA FORMAR 3 DIFERENTES TIPOS DE MATERIAIS HÍBRIDOS E COMPÓSITOS:
1ª PARTE:
- AEROGEL DO HÍBRIDO DA SÍLICA COM ÓXIDO DE METAIS
OBS.: NESTE CASO SERÁ ABORDADO SOBRE O DIÓXIDO DE TITÂNIO.
2ª PARTE (2º EXEMPLO):
- APRENDEREMOS COMO PODEREMOS PREPARAR OS MATERIAIS FOTOCRÔMICOS FILMES DOS MATERIAIS FOTOCRÔMICOS, E IREMOS DESCOBRIR ↓
- O QUE SÃO MATERIAIS FOTOCRÔMICOS (SERÁ DISCUTIDO ESTE ASSUNTO) E ↓
- O QUE SIGNIFICA MATERIAIS FOTOATIVOS E ↓
- COMO FAZER FILMES A BASE DE ORMOSILS
OBS.: NA AULA PASSADA FOI TRATADO SOBRE MATERIAIS A BASE DE SÍLICA, NO QUAL TRATAMOS SOBRE A SOLUBILIDADE DO TEOS, QUE É LIMITADA POR PRESENÇA DOS GRUPOS SIO2, OS QUAIS POSSUEM SÍLICA, PORTANTO, POSSUI SOLUBILIDADE LIMITADA, POR ISSO PRECISAMOS COLOCAR ÁLCOOL.
NOTA IMPORTANTE!
O TEOS POSSUI SOLUBILIDADE LIMITADA QUANDO MISTURADO COM MATERIAIS A BASE DE SÍLICA, E DEVIDO A ISSO SE FAZ NECESSÁRIO ADICIONAR ÁLCOOL A MISTURA, OU SEJA, PARA AUMENTAR A SOLUBILIDADE DA MISTURA.
(ÁUDIO RUIM) E PARA NOVAS MODALIDADES FALAMOS SOBRE ORGANOS SELANOS. A GENTE COLOCA UM GRUPO ORGÂNICO NA ESTRUTURA SELANO DO TEOS. A GENTE COLOCA UM GRUPO "R" PARA PODER TER NOVAS FUNCIONALIDADES. ENTÃO NESTA AULA FALAREMOS SOBRE MATERIAIS ORMOSILS (SELENOS MODIFICADOS ORGANICAMENTE). E NA ↓
3ª PARTE TRATAREMOS SOBRE:
- CELULOSE BACTERIANA, A QUAL É UM BIOCELULOSE, UM BIOPOLÍMERO, FEITO POR UM TIPO DE BACTÉRIA, E FORMAREMOS AEROGÉIS DELA, A QUAL FUNCIONA COMO UM ÓXIDO DE METAIS.
PORQUE A GENTE FOCA NOS ÓXIDOS DE METAIS DE SEMI-CONDUTORES?É DEVIDO A ESTES ÓXIDOS DE METAIS POSSUÍREM APLICAÇÕES NA PRODUÇÃO DE ENERGIA VOLTADO A SEPARAÇÃO DA ÁGUA (ÁUDIO RUIM - PARECE QUE É "HIDROGÊNIO")... E OXIGÊNIO PARA GERAÇÃO DE ENERGIA, (ÁUDIO RUIM) EM QUE OS ÓXIDOS DE METAIS SÃO IMPORTANTES PARA REMEDIAÇÃO AMBIENTAL, DEGRADAÇÃO DE POLUENTES. OS ÓXIDOS DE METAIS SÃO IMPORTANTES E ESSES SEMI-CONDUTORES TAMBÉM POSSUEM OUTRAS APLICAÇÕES EM VÁRIOS CAMPOS, POR ISSO A GENTE VAI TRATAR DOS MATERIAIS COMPÓSITOS E HÍBRIDOS A BASE DE ÓXIDOS DE METAIS. NA ↓
3ª PARTE SERÁ INTRODUZIDO UM OUTRO CONCEITO, EM QUE SE UTILIZA NANOTUBOS DO CARBONO DA ÚNICA PAREDE, OU ÚNICA CAMADA (SINGLE WALL), E COMO SÃO TUBOS, ELES TEM UM FORMATO (ÁUDIO RUIM)... SUPERFÍCIE DELES.
VEREMOS QUAL É A IMPORTÂNCIA DESTE NANOTUBO DE CARBONO NA ESTABILIDADE DAS PARTÍCULAS IMOBILIZADAS DOS METAIS NOBRES, COMO OURO, PRATA (...)
É DE SE PENSAR QUE ATRAVÉS DESTES 4 EXEMPLOS JÁ SERÁ POSSÍVEL TER UMA IDEIA SUFICIENTE PARA ENTENDERMOS OS MOTIVOS PARA SE FORMAR MATERIAIS HÍBRIDOS. PORQUE A IDEIA DOS MATERIAIS HÍBRIDOS SURGIU A PARTIR DO FATO DE QUANDO SE TEM UM TIPO DE MATERIAL COM UMA PROPRIEDADE.
CARACTERÍSTICAS DOS MATERIAIS ORGÂNICOS:
OUTROS TIPOS DE MATERIAIS, POR EXEMPLO, FOI INFORMADO PELA AULA ANTERIOR, QUE OS MATERIAIS ORGÂNICOS POSSUEM FLEXIBILIDADE, SÃO MENORES E FÁCEIS DE MANUSEAR.
CARACTERÍSTICAS E PROBLEMAS DOS MATERIAIS INORGÂNICOS:
JÁ OS MATERIAIS INORGÂNICOS POSSUEM UMA ESTABILIDADE TÉRMICA GRANDE, QUANDO COMPARADO AOS MATERIAIS ORGÂNICOS.
O PROBLEMA DOS MATERIAIS INORGÂNICOS É QUE ELES SÃO MUITO QUEBRADIÇOS OU QUEBRAM FÁCIL E POSSUEM MAIOR ESTABILIDADE TÉRMICA.
PERGUNTA:
QUAL SERIA O PROBLEMA DE UM MATERIAL POSSUIR GRANDE ESTABILIDADE TÉRMICA, COMO EXEMPLO SERIA UMA COMPARAÇÃO ENTE MATERIAIS ORGÂNICOS E INORGÂNICOS?CASO O LEITOR DESTE RESUMO SAIBA, DEIXE SEU COMENTÁRIO LOGO ABAIXO (COMENTÁRIOS DO FACEBOOK).
MATERIAIS HÍBRIDOS | A UNIÃO DO MATERIAL ORGÂNICO COM O INORGÂNICO:
ENTÃO, A IDEIA SURGIU PARA COLOCAR OS MATERIAIS ORGÂNICOS E INORGÂNICOS JUNTOS PARA SE OBTER UM MATERIAL QUE TEM O MELHOR DESTES DOIS MUNDOS (ORGÂNICO E INORGÂNICO), E PARA OBTER UM MATERIAL COM MELHORES PROPRIEDADES QUE SEUS COMPONENTES INICIAIS (PRECURSORES).
ESTES EXEMPLOS FOI ESCOLHIDO PARA JUSTIFICAR A FRASE QUE "OS MATERIAIS HÍBRIDOS TÊM MELHORES PROPRIEDADES EM COMPARAÇÃO COM MATERIAIS COMPONENTES".
(2º SLIDE)
- O PROCESSO DO SOL-GEL A PARTIR DE SiO2 - TiO2. NESTE CASO EM ESPECÍFICO, A SÍLICA SÓ SERVE COMO SUPORTE, E O TiO2 É A PARTE ATIVA, MAS QUANDO SE COLOCA ESTES DOIS MATERIAIS JUNTOS, A MISTURA DOS DOIS MELHORA MUITO A ESTABILIDADE TÉRMICA DO TiO2 E SUA FOTOATIVIDADE, E OUTRAS COISAS TAMBÉM SÃO AFETADAS POR ESTE PROCESSO DE MISTURAR ESTES DOIS ÓXIDOS. AO SE MISTURAREM É FORMADO UM COMPÓSITO QUE TAMBÉM É CHAMADO DE HÍBRIDO DA CLASSE 2.
(06:39 - PROFESSOR PERGUNTA SE ALGUÉM SABE O QUE É HIDROGEL...)
(07:01 - PROFESSOR EXPLICA PROCESSO DE SOL-GEL)
- COMO PREPARAR OS HIDROGÉIS DE SÍLICA E AEROGÉIS USANDO SOL-GEL;
- 1ª ETAPA; PROCESSO DE HIDRÓLISE (FORMAÇÃO DE UM "SOL");
COMO É A FORMAÇÃO DE UM "SOL"?
O "SOL" É A FORMAÇÃO DE PEQUENAS PARTÍCULAS DE ALGUNS NANÔMETROS SUSPENSAS EM UM SOLVENTE.
POLICONDENSAÇÃO:
- 2ª ETAPA; PROCESSO DE POLICONDENSAÇÃO; É UMA CONDENSAÇÃO QUE ACONTECE EM VÁRIAS DIREÇÕES - POR ISSO O NOME É POLICONDENSAÇÃO - ATÉ FORMAR UM GEL. ENTÃO ESTE PROCESSO SE CHAMA SOL-GEL, EM QUE O "SOL" É A PARTE INICIAL DO PROCESSO EM QUE OCORRE A FORMAÇÃO DE PEQUENAS PARTÍCULAS, E "GEL" É QUANDO ESSAS PEQUENAS PARTÍCULAS (SOL) VÃO SE JUNTANDO (AGLOMERANDO) PELOS VÁRIOS TIPOS DE INTERAÇÕES, AS QUAIS PODEM SER INTERAÇÕES FRACAS E FORTES.
EM MUITOS CASOS É UMA LIGAÇÃO QUÍMICA. AÍ ESSES GÉIS RESULTANTES TÊM SOLVENTE EMBUTIDO OU PRESO NO MEIO DOS POROS DESSE GEL, ENTÃO A GENTE PODE CHAMAR DE SOL-GEL. VEMOS QUE QUANDO TEM ÁLCOOL A GENTE PODE CHAMAR DE ALCOOLGEL. JÁ QUANDO TEM ÁGUA NO MEIO DESSES GÉIS A GENTE PODE CHAMAR DE HIDROGÉIS (HIDROGEL). A OUTRA É AEROGEL QUE ADIANTE SERÁ ABORDADO EM DETALHE JUNTO COM O HIDROGEL.
(08:37 HORAS - SILÊNCIO - UM ALUNO FAZ UM COMENTÁRIO SOBRE UMA ETAPA DO PROCESSO PARA SE FORMAR HIDROGEL)
(08:46 HORAS - PROFESSOR CONTINUA...)
IREMOS ABORDAR ADIANTE SOBRE AEROGEL, QUANDO SE PASSA O HIDROGEL NUMA SECAGEM SUPERCRÍTICA. SERÁ DISCUTIDO COMO FUNCIONA ESTE PROCESSO, DESDE QUANDO SE FAZ UM TRATAMENTO DESTE HIDROGEL USANDO SECAGEM SUPERCRÍTICA, EM QUE SE OBTÉM UM MATERIAL SÓLIDO, MUITO LEVE E POROSO, DENSIDADE MENOR POSSÍVEL, CONHECIDO COMO O SÓLIDO (AEROGÉIS) MAIS LEVE DO MUNDO. OS AEROGÉIS POSSUEM UMA PROPRIEDADE ÚNICA, MUITO MELHORES, QUE SERÁ MAIS DETALHADO NO PRÓXIMOS SLIDES.
2ª PARTE DESTA AULA, SERÁ TRATADO SOBRE:
- COMO PODEMOS (...) "ENCARAR" O TiO2 NESSES AEROGÉIS E HIDROGÉIS DA SÍLICA. ENTÃO IREMOS FORMAR UM GEL COMPÓSITO. JÁ NA ↓
3ª PARTE IREMOS TENTAR CARACTERIZAR ESSES COMPÓSITOS PARA VER ↓
1º) COMO A GENTE PODE RELACIONAR A SUA ESTRUTURA, A HIBRIDIZAÇÃO DA ESTRUTURA, A FORMAÇÃO DO COMPÓSITO ESTRUTURAL, DAS PROPRIEDADES DO COMPÓSITO, POR EXEMPLO, QUANDO SE MISTURA A SÍLICA (SiO2) COM TiO2, ↓
2º) O QUE ACONTECE COM A ESTABILIDADE TÉRMICA?
3º) O QUE ACONTECE COM AS PROPRIEDADES FOTOATIVAS (TIPO FOTOCATÁLISE DO MATERIAL)?,
PORQUE QUANDO SE MISTURA OS DOIS (SiO2-TiO2) NO PROCESSO SOL-GEL, EXISTE UMA HIBRIDIZAÇÃO ESTRUTURAL E ISSO LEVA A FUNÇÕES MELHORES QUE DO TiO2 PURO. ENTÃO, O ↓
1º EXEMPLO DESSA AULA SERVIRÁ PARA MOSTRAR ESTES 3 PONTOS (SUPRACITADOS).
(3º SLIDE) - 10:32
COMO DITO, OS AEROGÉIS TEM ALGO HAVER COM SECAGEM SUPERCRÍTICA. ENTÃO, SE ALGUÉM PERGUNTAR ↓
O QUE SIGNIFICA AEROGÉIS?
PODEMOS DIZER QUE SÃO SÓLIDOS, NO ENTANTO ESTE SÓLIDOS SÃO FORMADOS A PARTIR DE UM GEL QUE PASSOU POR UM SECAGEM ESPECIAL QUE A CHAMAMOS DE SECAGEM SUPERCRÍTICA (SUPERCRITICAL DRYING), ↓
(11:03) PROCESSO DE FORMAÇÃO DO SOL-GEL:
MAS ANTES SERÁ ABORDADO SOBRE OS PROCESSOS DO SOL-GEL. DEVEMOS LEMBRAR QUE NA ↓
1ª ETAPA DEVEMOS MISTURAR O PRECURSOR QUE PODE SER ALCOÓXIDO OU CLORETO DO METAL PARA SER FEITO A HIDRÓLISE DESTA MISTURA, E DEPOIS NA ↓
2ª ETAPA A MISTURA SOFRE A CONDENSAÇÃO E FORMA UM "SOL", E ESTE SOL (QUE TEM PARTÍCULAS MUITO PEQUENAS) VAI SE CONDENSANDO ATÉ SE AGLOMERAR AO PONTO DE FORMAR UM GEL (QUE TAMBÉM PODE SE CHAMAR HIDROGEL QUANDO ELE É FORMADO EM ÁGUA, OU ALCOOGEL SE FORMADO EM ÁLCOOL, TUDO VAI DEPENDER DO SOLVENTE (SOL) UTILIZADO PARA FORMÁ-LO).
(3ª ETAPA) ENTÃO, SE PEGA ESTE GEL E FAZ UMA SECAGEM SUPERCRÍTICA (NO PRÓXIMO SLIDE SERÁ ABORDADO SOBRE A SECAGEM SUPERCRÍTICA) PARA SE OBTER UM MATERIAL SÓLIDO OU UM MONOLÍTICO AEROGEL (EM INGLÊS É MONOLITHIC) QUE SIGNIFICA "UMA PARTE GRANDE DO MATERIAL".
(12:11) CARACTERÍSTICAS DO AEROGEL:
DIMENSÕES:
ENTÃO, QUANDO SE VÊ O MATERIAL NOTA-SE QUE ELE É GRANDE, DÁ PARA SEGURAR NAS MÃOS, É UM PEDAÇO GRANDE, É UM ÚNICO PEDAÇO GRANDE, MAS QUANSE SE OBSERVA A ESTRUTURA DESTE MONOLÍTICO EM DETALHES, SE VÊ PEQUENAS PEQUENAS PARTÍCULAS INDIVIDUAIS QUE TÊM TAMANHOS COM CERCA DE 10 OU 20 nm,
MATERIAL MACRO COM PROPRIEDADES NANOMÉTRICAS:
E AINDA TEM OUTRA PROPRIEDADE, ELE (AEROGEL) TEM POROS NO MEIO DESSAS PARTÍCULAS QUE FORMAM UMA REDE TRIDIMENSIONAL, OU SEJA, HÁ POROS ENTRE AS SUAS PARTÍCULAS. ENTÃO O AEROGEL É SÓLIDO, UM MATERIAL CONSIDERADO MACRO E COM PROPRIEDADES NANOMÉTRICAS, A ESTRUTURA DELE É FEITO POR NANOPARTÍCULAS E AINDA TEM POROS, E TAMBÉM O MATERIAL É CONSIDERADO MESOPOROSO PORQUE POSSUI PARTÍCULAS COM TAMANHOS QUE VARIAM DE 2 A 50 nm. PODEMOS VER QUE ESTAMOS FAZENDO UMA PONTE ENTRE MATERIAIS NANOESTRUTURADOS COM MACRO-OBJETOS.
PODE-SE NOTAR QUE O PEDAÇO (DO AEROGEL) EM SI É GRANDE, MAS QUANDO SE OBSERVA AS PROPRIEDADES DA ESTRUTURA DELE, VEMOS PROPRIEDADES NANOMÉTRICAS NUMA ESTRUTURA MACRO, OU SEJA, O OBJETO É MACRO MAS TEM AS CARACTERÍSTICAS DE MATERIAL NANOMÉTRICO E, COMO JÁ DITO, O AEROGEL POSSUI UMA ESTRUTURA POROSA, É UM SÓLIDO COM UMA ESTRUTURA POROSA, ABERTA, QUE A GENTE PODE OBTER ATRAVÉS DE UMA SECAGEM SUPERCRÍTICA DO GEL QUE É FEITO PELO PROCESSO SOL-GEL.
AGORA,
PORQUE É FEITO A SECAGEM SUPERCRÍTICA?
SECAGEM EM TEMPERATURA AMBIENTE:
PORQUE QUANDO SE TEM UM GEL, E O SECAMOS NA TEMPERATURA AMBIENTE, QUANDO A ÁGUA (OU QUALQUER SOLVENTE UTILIZADO NO PROCESSO SOL-GEL) SAI DESSES POROS OS COLAPSANDO, OU SEJA, ESSES POROS SOFREM UM COLAPSO, ENTÃO SE PERDE ESTA POROSIDADE AO SE USAR UMA SECAGEM NORMAL, POR EXEMPLO COLOCANDO NUMA ESTUFA.
SECAGEM SUPERCRÍTICA:
JÁ QUANDO É FEITA A SECAGEM SUPERCRÍTICA, É TIRADO (COMPLETAMENTE) TODO O SOLVENTE (DOS POROS)...
POR EXEMPLO, SE UTILIZARMOS O ETANOL COMO SOLVENTE, ENTÃO TEREMOS ETANOL NOS POROS DA ESTRUTURA DO AEROGEL, ENTÃO SE UTILIZA O CO2 PARA SUBSTITUIR ESTE ÁLCOOL (ETANOL) DOS POROS DA ESTRUTURA DO AEROGEL,
(CONTINUA NO PRÓXIMO VÍDEO - PARTE 2 QUE SEGUE ABAIXO)...
Parte 2
Parte 3:
Parte 4:
ANOTAÇÕES | PARTE 4:
AREOGEL SiO2-TiO2 (AEROGEL MISTO): MÉTODO DE DEPOSIÇÃO TERMO-INDUZIDA (TID) DE TiO2
FORMAÇÃO DE AEROGEL MISTO:
NO PROCESSO DE FORMAÇÃO DE GEL COMPÓSITO, HÁ UM COBRIMENTO DAS PARTÍCULAS DO GEL ÚMIDO DE SÍLICA COM TiO2.
PARA ISTO, ↓
1º) PEGA-SE O GEL ÚMIDO DE SÍLICA (QUE JÁ PASSOU DA FASE "SOL" PARA FASE "GEL" MAS QUE AINDA NÃO FOI FEITO A SECAGEM SUPERCRÍTICA) E ↓
2º) O MERGULHA NUM RECIPIENTE COM A MISTURA DOS PRECURSORES DE TiO2 (+ ÁGUA), ↓
3º) DEPOIS AQUECE ESTA MISTURA (SOLVENTE) DO RECIPIENTE A 80°C ATÉ OBTER-SE UMA REAÇÃO DE DEPOSIÇÃO DO TiO2 SOBRE A SÍLICA, E POR FIM, ↓
4º) FAZ A SECAGEM SUPERCRÍTICA E PODERÁ SER VISTO OS DETALHES DESTE AEROGEL, EM QUE AS PARTÍCULAS DA SÍLICA ESTARÃO COBERTAS POR TiO2.
LOGO, FOI POSSÍVEL FAZER UM AEROGEL MISTO, O QUAL POSSUI SÍLICA ENCOBERTA COM PARTÍCULAS DO TiO2.
APÓS AQUECER A MISTURA COM O GEL ÚMIDO A 80°C, OBTÉM-SE O CORE-SHELL (NÚCLEOS DE CASCAS) OU CASCA DA SÍLICA, OU UM TiO2 COM CORAÇÃO DE SÍLICA OU UMA CASCA DE TiO2 POR VOLTA DA SÍLICA, NO ENTANTO O MATERIAL CONTINUA COM SEUS POROS PORQUE O TiO2 COBRE APENAS AS PARTÍCULAS DA SÍLICA.
QUANTO MAIS SE ADICIONA TiO2 A MISTURA, MAIS BRANCO (CLARO) FICARÁ O MATERIAL A SER COBERTO, QUE NESTE CASO É A SÍLICA. POR FIM, MESMO SENDO COBERTO AS PARTÍCULAS DA SÍLICA POR TiO2, O MATERIAL CONTINUA COM SUAS PARTÍCULAS NANOMÉTRICAS E COM CARACTERÍSTICAS DE MACRO-OBJETO.
- ATRAVÉS DE UMA IRRADIAÇÃO DE RAIO X MUITO ALTA SOBRE UM ÁTOMO, UM ELÉTRON DA 1ª CAMADA ORBITAL DESTE ÁTOMO É ARRANCADO PARA FORA DA SUA ÓRBITA, NO ENTANTO, UM ELÉTRON DA PRÓXIMA CAMADA SUBSTITUI O LUGAR DESTA QUE SAIU FORA, E NESTE MOMENTO EM QUE O ELÉTRON SE MOVE PARA OCUPAR ESTE LUGAR (LACUNA), O UM ÁTOMO EMITE UM RAIO X (FEIXE DE LUZ) QUE, AO MEDIR O COMPRIMENTO DE ONDA DESTE RAIO X, É POSSÍVEL SABER QUAL ÁTOMO QUE O EMITIU E DESCOBRIR QUAL É O PERCENTUAL DE COMPOSIÇÃO DESTE ÁTOMO NUMA DETERMINADA AMOSTRA. ESSA TÉCNICA SE CHAMA FLUORESCÊNCIA DE RAIO X.
NOTAS:
- TiO2 | FASES POLIMÉRICAS:
O TiO2 É UM MATERIAL SEMICONDUTOR QUE ↓
APRESENTA DIFERENTES FASES POLIMÓRFICAS, SENDO A ↓
BRUQUITA, ANATASE E RUTILO AS MAIS ESTUDADAS.
DENTRE AS TRÊS, A ↓
BRUQUITA É A MENOS ESTÁVEL TERMICAMENTE, A ↓
ANATASE É METAESTÁVEL, PODENDO SER TRANSFORMADA EM ↓
RUTILO, QUE É A MAIS ESTÁVEL.
- ÁTOMO DE BOHR:
NA FÍSICA ATÔMICA, O ÁTOMO DE BOHR É UM MODELO QUE DESCREVE O ÁTOMO COMO UM NÚCLEO PEQUENO E CARREGADO POSITIVAMENTE CERCADO POR ELÉTRONS EM ÓRBITA CIRCULAR.
- FLUORESCÊNCIA DE RAIO X:
 |
| Fonte aqui! |
PARA EFEITO DE EXEMPLO, IMAGINEMOS UM MODELO DE BOHR, EM QUE ATRAVÉS DE UMA IRRADIAÇÃO DE RAIO X MUITO ALTA SOBRE UM ÁTOMO, UM ELÉTRON DA 1ª CAMADA ORBITAL DESTE ÁTOMO É ARRANCADO PARA FORA DA SUA ÓRBITA, NO ENTANTO, UM ELÉTRON DA PRÓXIMA CAMADA SUBSTITUI O LUGAR DESTA QUE SAIU FORA, E NESTE MOMENTO EM QUE O ELÉTRON SE MOVE PARA OCUPAR ESTE LUGAR (LACUNA), O ÁTOMO EMITE UM RAIO X (FEIXE DE LUZ) E, AO MEDIR O COMPRIMENTO DE ONDA DESTE RAIO X, É POSSÍVEL SABER QUAL ÁTOMO QUE O EMITIU E DESCOBRIR QUAL É O PERCENTUAL DE COMPOSIÇÃO DESTE ÁTOMO NUMA DETERMINADA AMOSTRA. ESSA TÉCNICA SE CHAMA FLUORESCÊNCIA DE RAIO X.
TiCl4 é o precursor do TiO2
Parte 5:
FOTODEGRADAÇÃO:
Produção de energia através da absorção de radiação ultravioleta. Dado que absorvem a radiação ultravioleta do sol e produzem energia sob a forma de calor.
(1:53) Por que a TiO2 (anatase) em SiO2-TiO2 tem maior estabilidade térmica que o TiO2 puro?
RESPOSTA: Devido a sílica (SiO2) presente na mistura, a qual ajuda a ter uma maior resistência a mudança da área superficial quando se aumenta a temperatura de tratamento do material.
Nota:
(05:15) A sílica aumenta a resposta fotocatalítica, ou seja, aumenta a velocidade da reação através da foto-reação.
(05:21) A formação do compósito SiO2-TiO2 ajuda a obter:
- uma estabilidade térmica maior que do TiO2 puro;
- um tamanho de cristalito menor que o do TiO2, que é bom para a fotocatálise;
- uma atividade fotocatalícitica maior que TiO2 puro.
Parte 6:
ANOTAÇÕES | PARTE 6
FOTOCROMISMO
Fotocromismo ou efeito fotocromático é aquele que resulta na modificação da cor do material ou no seu escurecimento quando recebe luz, seja artificial, seja solar.
Exemplos de aplicações: lente de óculos com revestimento óptico que muda de cor (escurece) dependendo da radiação ultravioleta (UV) recebida para proteger os olhos de altas exposições. Outro exemplo similar seriam as janelas com vidros inteligentes, estes evitam absorções de raios infravermelhos (IV) para o interior da edificação.
Os materiais fotocrômicos são bseados em compostos orgânicos, e existem poucos trabalhos com base em apenas inorgânicos.
Característica muito importante dos superácidos:
Os superácidos podem receber elétrons ou prótons formando uma espécie de vaências mistas de coloração azul, conhecido no Inglês como heteropolyblues.
A resposta fotocrômica depende:
- do potencial redox;
- pH do meio;
- presença dos grupos orgênicos que podem fornecer/receber prótons (H+) ou elétrons (e-).
Devido a isso que se está sendo colocado ORMOSIL, tal qual possui grupamento orgânico e a matriz da sílica.
PERGUNTA!Se você (leitor) sabe a resposta, deixe ela nos comentários abaixo:
O que significa dizer que um dado material possui matriz da sílica, por exemplo?
Parte 7:
ANOTAÇÕES | PARTE 7
Funcionamento do fotocromismo.
HOMO significa orbitais molecuraes de energia mais alta possível que estão preenchidos. O HOMO é constituído por "2p" dos oxigênio (O-2).
A diferença entre HOMO e LUMO cai na região do UV. Se irradiar este ácido com UV, teremos uma transição do elétron de HOMO para LUMO, ou seja, o que era W5+ passa a ser W6+ (imagem abaixo) porque perdeu 1 elétron, e neste caso estamos aumentando o elétron do tungstânio, onde estaremos formando uma espécie com valências mistas.
Logo, se esta amostra recebe radiação ultravioleta (UV), ela ficará azul, e se fizermos o espectro deste azul, notaremos uma absorvância forte, conforme é demostrado pelo gráfico abaixo:
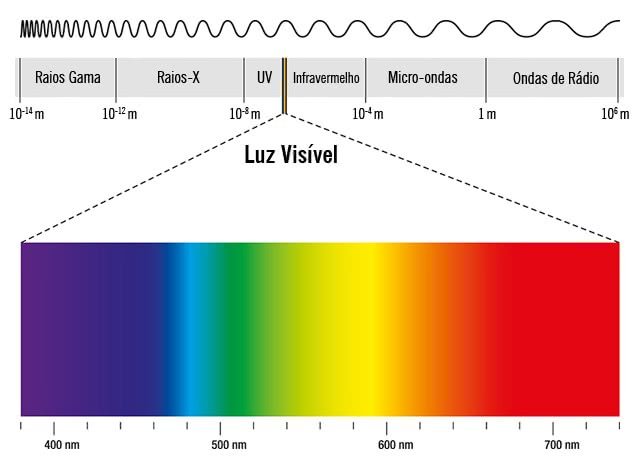
No entanto, vale observar a imagem abaixo para entender melhor a cor da luz conforme seu comprimento de onda:
Então se a amostra recebe UV, teremos uma coloração azul por conta do gráfico de absorvância ser mais forte neste tipo de comprimento de onda.
Já se deixarmos esta amostra exposta ao ar (oxigênio), a absorvância vai caindo porque estaremos tirando o tungstânio (W+5), o oxidando, ou seja, fazendo o mesmo processo do (UV), de W5+ para W6+.
(03:25) Materiais fotocrômicos baseados em POMs
Estes compósitos são muito solúveis, logo, não poderemos manuseá-los facilmente, porque qualquer coisa com água o dissoverá, então se faz necessário incorporá-los a uma matriz sólida, ou seja, é por isso que precisamos fazer um híbrido.
(03:59) Os materiais fotocrômicos inorgânicos apresentam bastante propriedades boas, sendo sua único problema sua a alta solubilidade em água.
(04:18) Sua matriz deve possuir propriedades mecânicas, óticas e químicas adequadas, ou seja, quando se diz propriedades mecânicas quer dizer que se pode formar várias estruturas, como exemplo os filmes, já as propriedades óticas significa que ela não pode absorver UV, por se caso absorva, o seu componente ativo não absorverá o UV na mesma região que a matriz absorve.
(05:10) Materiais Híbridos Orgânico-Inorgânico
- O Ormosil (Silicato Orgânico Modificado) é uma representação muito boa preparar via rota sol-gel empregando precursores organosilanos.
- Matriz adequada para incorporação de compostos fotocrômicos, além de permitir a obtenção de materiais na forma de filmes.
Um estudo por Elias et al. revelou que a adição dos cátions Zn2+ durante a síntese sol-gel possibilita a preparação de filmes fotocrômicos de Ormosil-fosfotungstato com resposta fotocrômica superior.
Nota:
(11:34) Superácido: todo composto de acidez até 100% maior que a do ácido sulfúrico. De um modo geral, os superácidos, são usados como catalisadores de reações orgânicas, especialmente pela indústria petrolífera, na gaseificação do carvão mineral e em reações com petróleo cru, quebrando as moléculas e produzindo plásticos fortes e octanos gasosos sem chumbo. Os superácidos são praticamente os únicos reagentes que podem ser utilizados com o petróleo.
Parte 8:
ANOTAÇÕES | PARTE 8
(00:11) Preparação de filmes | Método clássico de preparação de material híbrido
Preparo dos precursores (TEOS, etanol e BuTS) para formação da matriz:
1º) Pega-se o TEOS (precursor da sílica), depois ↓
2º) se coloca etanol, que é o solvente para dissolver o TEOS, depois ↓
3°) se coloca BuTS, que é a mesma coisa que o TEOS, no entanto ele tem um grupamento organossilano (composição formada por misturação de um organossilano com um carbonato orgânico),
Após a mistura dos precursores para formação da matriz, coloca-se ↓
4º) o composto +H3 PW12 O40, tal qual é um pigmento, ácido fosfotúngstico para dar coloração (representação da estrutura do ácido na figura abaixo).
 |
| Fonte aqui! |
Após a mistura do ácido supracitado para dar coloração, adiciona-se ↓
5º) Glymo (nome do Inglês), que também é precursor da sílica, para ajudar na formação de estruturas laminares (filmes), criar conexões entre camadas do material para formar bons filmes.
6º) Adiciona-se água (CONTINUA APÓS PERGUNTA ABAIXO)
PERGUNTA!
(02:11) Por que colocamos H2O na síntese mostrado no slide 26?
POSSÍVEL RESPOSTA: Em análise ao slide 26, o qual segue representado pela figura abaixo, foi elaborado uma justificativa para este problema.
Portanto, pode-se justificar que, a adição de água (H2O) pode servir para produzir um aumento na porosidade do híbrido. No entanto, vale frisar que, os materiais híbridos a base de sílica apresenta apreciável solubilidade em solventes com elevada constante dielétrica, como água e etanol e, consequentemente, podem ser facilmente depositados sobre outras matrizes inorgânicas, ou mesmo utilizados como precursores moleculares para síntese de híbridos contendo teor inorgânico mais elevado. (BENVENUTTII, C. MORO, et al., 2009).
Caso o leitor desta postagem tenha uma resposta diferente, poste-a nos comentários do Facebbok abaixo:
Depois da adição de água veremos a formação do Sol ↓
Após a formação deste Sol, poderemos fazer duas coisas, um monolito ou para deposição de filmes (como exeplo, revestir um vidro de uma janela inteligente).
6.1º) FAZER MONOLITO - Se evaporarmos este Sol (figura acima) a uma temperatura ambiente, teremos a formação de monólito ↓
Conforme é demonstrado pela imagem acima, ao adicionar Zinco a mistura, ele estará ajudando a aumentar a resposta fotocrômica (escurece mais) da mistura.
CARACTERIZAÇÃO FTIR
Como nosso curso envolve a difração de raios X e espectroscopia Raman (FITR) e a Microscopia Eletrônica de Transmissão (TEM), veremos algumas caracterizações desses materiais que estamos estudando, e fazermos um aprendizado básico do que usamos para fazer essas técnicas de caracterização, o qual é a proposta do curso.
Processo de caracterização:
1º) Tiramos o espectros de infravermelho dos materiais de filmes híbridos (que mais adiante desta videoconferência serão chamados de filmes híbridos do Ormosil-Fosfotungstato dopado com íons), depois ↓
2º) veremos o gráfico dos espectros de FTIR dos pós de xerogéis de Ormosil-fosfotungstato para vermos se tem alguma formação lacunar [PAREI EM 06:14 - PARTE 8]...
Parte 9:
CALENDÁRIO DE TÓP. ESP.: SÍNT. CARAC. DE MAT. (TE) | MESTRADO | CIÊNCIAS DOS MATERIAIS - UFMS
CALENDÁRIO DE TÓP. ESP.: SÍNT. CARAC. DE MAT. (TE) | MESTRADO | CIÊNCIAS DOS MATERIAIS - UFMS
"Quando o mundo estiver unido na busca do conhecimento, e não mais lutando por dinheiro e poder, então nossa sociedade poderá enfim evoluir a um novo nível."
























Comentários
Postar um comentário